Azoto: differenze tra le versioni
imported>Elisa Paglia Nessun oggetto della modifica |
(Nessuna differenza)
|
Versione attuale delle 16:18, 20 mar 2025
Template:Nota disambigua Template:Nota disambigua Template:Elemento chimico L'azoto (è un elemento chimico della tavola periodica degli elementi con simbolo N la cui forma prevalente è l'azoto molecolare, detto anche azoto biatomico, azoto diatomico, diazoto o semplicemente azoto, formato da due atomi di azoto (N2).[1]
Storia
Template:Vedi anche A partire dal 1500 gli scienziati iniziarono a proporre l'idea della presenza in un altro gas nell'atmosfera oltre all'ossigeno e all'anidride carbonica, ma non furono in grado di provarlo fino al 1700.[2] Template:Dx La scoperta venne fatta nel 1772 e fu attribuita a Daniel Rutherford, un allievo di Joseph Black, nonostante fosse stato contemporaneamente identificato anche da Joseph Priestley, Carl Wilhelm Scheele e Henry Cavendish.[2]
Nel 1958 l'isotopo 15N arricchito è stato utilizzato per dimostrare la replicazione semiconservativa del DNA.[3]
Secondo alcune fonti, il termine fu coniato nel 1787 dal chimico francese Louis-Bernard Guyton-Morveau. Il nome "nitrogène" fu invece suggerito dal chimico francese Jean-Antoine Chaptal nel 1790,[4] quando si scoprì che l'azoto era presente nell'acido nitrico e nei nitrati. Antoine Lavoisier propose invece il nome "azote", dal greco antico: ἀζωτικός, che significa "senza vita". In inglese si è conservata la denominazione nitrogen,[5] mentre in tedesco viene chiamato stickstoff.[6]
Abbondanza e disponibilità
Abbondanza
L'azoto è:
- il quinto elemento più abbondante nell'universo,[7] il settimo per abbondanza nella Via Lattea e nel sistema solare;[8]
- il 19º sulla crosta terrestre, di cui costituisce lo 0,02%[2] (57% organico - 43% inorganico);[9]
- il primo elemento per abbondanza nell'aria, di cui costituisce il 78,09%;[2]
- il quarto elemento più presente del corpo umano, di cui costituisce il 3%[2]
Universo
Nell'universo l'azoto viene prodotto principalmente da stelle di massa ridotta e itermedia (LIMS), con rese nucleosintetiche che dipendono in modo complesso dalla metallicità. In particolare, una generazione stellare può rilasciare nel mezzo interstellare (ISM) della galassia, sia azoto primario che secondario.[7]
La componente primaria viene prodotta durante il terzo evento di dragaggio, che si verifica lungo la fase di ramo asintotico delle giganti (AGB), se la combustione nucleare alla base dell'involucro convettivo è efficiente.[10] La componente di azoto secondario aumenta con la metallicità. Essendo un prodotto del ciclo del carbonio-azoto-ossigeno, l'azoto si forma a spese del carbonio e dell'ossigeno presenti nella stella.[7]
Atmosfera
Nell'atmosfera terrestre è presente sotto forma di molecola biatomica N2, chimicamente inerte per via del forte triplo legame; tuttavia, i processi biotici possono assimilarlo e trasformarlo in specie reattive come nitrito (NO2−), nitrato (NO3−) e ammonio (NH4+) nella biosfera.[11] Nell'atmosfera sono presenti 4 x 1018 kg di azoto (99,96% dell'azoto totale presente sulla Terra).[9][12]
Crosta terrestre
La quantità totale di azoto presente nella crosta terrestre non è ben definita per tre diversi motivi:[13][14][15]
- dipende dal materiale precursore della Terra
- il contenuto di azoto nel nucleo terrestre non è ben determinato
- la concentrazione di azoto nei diversi serbatoi può variare nel corso del tempo geologico
Si stima che la quantità di azoto presente nella crosta terrestre si aggiri tra i 50 e gli 88 μg/g.[14][16][17] Utilizzando il valore stimato più recente (74 μg/g)[14] si arriva ad avere una quantità totale di azoto nella crosta terrestre pari a 1,4 × 1018 kg.[11]
La distribuzione dell'azoto tra i vari serbatoi riflette i meccanismi di riciclo. Un contributo importante al riciclo dell'azoto è rappresentato dalle zone di subduzione,[18][19] dove i sedimenti contenenti materiali organici ricchi di azoto scendono nel mantello. Le condizioni redox giocano un ruolo cruciale nel processo di discesa, poiché la fugacità dell'ossigeno governa la speciazione dell'azoto.[20]
Una parte dell'azoto viene rilasciata negli oceani e nell'atmosfera attraverso la degassazione del N2. L'azoto nei minerali silicatici (minerali argillosi, mica, feldspato, granato, wadsleyite e bridgmanite) esiste prevalentemente come NH4+. L'azoto si trova anche nella grafite e nel diamante, dove si presenta in forma elementare. I nitruri sono stabili in condizioni estremamente riducenti, come quelle esistenti durante i processi di formazione planetaria primordiale, e potrebbero ancora persistere nel mantello inferiore.[20]
Oceani
Negli oceani sono presenti 2,4 × 1016 kg di azoto con l'N2 come specie dominante e altre specie minori come NO3−, NH4+ e N2O.[21][22]
Biomassa
Nella biomassa il contenuto totale di azoto si attesta intorno a ∼9.6 × 1014 kg.[22] Circa il 96% è contenuto nella materia organica presente nel suolo, mentre il restante 4% è contenuto negli organismi viventi di cui il 94-99% è contenuto nelle piante e solo l'1-6% negli animali e nei microrganismi, tuttavia questa proporzione dipende dello specifico ecosistema.[23][24]
Negli organismi viventi, l'azoto può essere trovato sotto forma di gas all'interno delle cellule e/o in forma ossidata o ridotta. In forma ridotta è il componente principale delle più importanti macromolecole biologiche: le proteine/polipeptidi, il DNA/RNA e nei polimeri degli amminozuccheri. Altre molecole contenenti azoto sono le porfirine e alcuni metaboliti secondari delle piante.[23]
Da notare il fatto che l'azoto viene prodotto naturalmente dall'E.coli ceppo K12[25] e dal P. rhodosperma.[26]
Disponibilità

Prima delle attività antropiche, l'azoto disponibile per gli organismi derivava principalmente dall'azotofissazione e dai fulmini.[27][28] Tuttavia la disponibilità è cambiata drasticamente a causa delle attività umane.[28][29] Infatti, più azoto viene fissato annualmente a causa dell'impatto dell'uomo rispetto a quello fissato attraverso i processi naturali.[29]
I più importanti sono la fissazione industriale e agricola dell'azoto e la fissazione dell'azoto attraverso la combustione di combustibili fossili. Inoltre, la combustione della biomassa e la conversione/disboscamento dei suoli accelerano la mobilizzazione dell'azoto.[29][30]
Sebbene la maggior parte dell'azoto non atmosferico sia accumulata in rocce, sedimenti e depositi organici, la sua disponibilità è severamente limitata.[31][32] Questa carenza complessiva, non solo dalla litosfera, rende l'azoto uno dei nutrienti più importanti e limitanti.[32]
Chimica nucleare
- numero atomico = 7
- massa atomica = 14,0067u
- massa molecolare = 28,014 g/mol
- massa monoisotopica = 28,006148008 Da
- superficie polare = 47,6 Ų
Isotopi
| Nuclide | Abbondanza | Massa | Spin | Emivita | Decadimento |
|---|---|---|---|---|---|
| 10N | — | 10,0416 | 2- | Template:Val | p |
| 11N | — | 11,0261 | ½ | Template:Val | p |
| 11mN | — | ½ - | Template:Val | n.m. | |
| 12N | — | 12,0186 | 1 | 0,011 s | β+ |
| 13N | — | 13,0057 | ½ - | 9,965 min | β+ |
| 14N | 99,636 | 14,0031 | 1 | stabile | — |
| 15N | 0,364 | 15,0001 | ½ - | stabile | — |
| 16N | — | 16,0061 | 2- | 7,13 s | β− |
| 17N | — | 17,0084 | ½ - | 4,173 s | β− |
| 18N | — | 18,0141 | 1- | 0,622 s | β− |
| 19N | — | 19,0170 | ½ - | 0,271 s | β− |
| 20N | — | 20,0237 | n.m. | 0,13 s | β− |
| 21N | — | 21,0270 | ½ - | 87 ms | β− |
| 22N | — | 22,0344 | n.m. | 13,9 ms | β− |
| 23N | — | 23,0405 | ½ - | >14,5 ms | β− |
| 24N | — | 24,0505 | n.m. | <52 ns | n |
| 25N | — | ½ - | <260 ns | n.m. |
Sono noti due isotopi stabili - 14N (99,63%) e 15N (0,37%)[34] - e numerosi radionuclidi con tempo di dimezzamento brevissimo.[35][36] Il più comune degli isotopi stabili dell'azoto è il 14N, nell'atmosfera infatti il rapporto 15N:14N è pari a 0,3663 e di cui lo 0,73% è dato dall'isotopomero 14N15N, mentre il resto è 14N2.[34] Questi due isotopi stabili partecipano a diversi processi chimici che vanno dai meccanismi di reazione enzimatica al ciclo biogeochimico.[37][38] Le differenze nel rapporto tra i due isotopi di azoto nei vari composti sono principalmente una conseguenza della tendenza dell'isotopo leggero dell'azoto a reagire a una velocità maggiore rispetto all'isotopo pesante.[34] Quattordici isotopi radioattivi sono stati identificati, ma hanno tempi di decadimento troppo brevi per essere utili in geochimica. Le variazioni degli isotopi stabili dell'azoto terrestre hanno origine da effetti vibrazionali e sono quindi piuttosto limitate.[39]
Gli isotopi dell'azoto vengono quasi esclusivamente misurati utilizzando l'N₂ come analita e spettrometri di massa a rapporto ionico con sorgente a gas ad impatto elettronico (IRMS) operanti in modalità di pompaggio dinamico (ossia, il campione viene o ionizzato, accelerato e rilevato o immediatamente eliminato). Storicamente, l'azoto veniva estratto dalla sua matrice, convertito quantitativamente in gas N₂, purificato utilizzando tecniche di estrazione sottovuoto offline e analizzato mediante spettrometria di massa a doppia entrata. La dimensione tipica del campione è >5 micromoli e la precisione sul d¹⁵N è migliore di 0,1‰ (1σ).
Il metodo storico per l'analisi di campioni solidi (es. rocce, minerali, suoli) – generalmente noto come combustione di Dumas – consiste nell'ossidare il campione in un tubo sigillato a circa 900 °C; eventuali ossidi di azoto vengono ridotti dal rame a circa 600 °C e CO₂, SO₂ e H₂O vengono separati dall'N₂ utilizzando azoto liquido o ossido di calcio (es., Kendall e Grim 1990). Attualmente, l'azoto può essere estratto con vari metodi, tra cui frantumazione, ablazione laser e riscaldamento con laser o forno (in condizioni ossidanti, inerti o riducenti), e purificato utilizzando tecniche di cromatografia a gas e/o tecniche chimiche e criogeniche. È anche interessante notare che gli isotopi di N e O dei nitrati vengono comunemente analizzati utilizzando batteri denitrificanti coltivati che rilasciano N₂O.
Reazioni nucleari
Nel 1919 Ernest Rutherford fece passare le particelle alfa generate da un radionuclide naturale attraverso una camera contenente atomi di azoto e scoprì che veniva prodotta un'altra radiazione, più penetrante. Dimostrò che questa nuova radiazione consisteva di protoni di alta energia e concluse che questo era il risultato della conversione dei nuclei di azoto in nuclei di ossigeno. Rutherford ipotizzò che la cattura di una particella alfa da parte del nucleo dell'azoto produce un nucleo eccitato di fluoro-18, che a sua volta emette un protone formando nuclidi di ossigeno-17, un isotopo raro ma stabile
- α + 14N → 18F* → 17O + p
Nell'atmosfera, per effetto dei raggi cosmici, avviene la seguente reazione:
- 14N + n → 14C + p ΔE = Template:M
Se i neutroni hanno energia molto elevata la reazione può decorrere in modo differente dando luogo a trizio:
- 14N + n → 12C + 3H ΔE = 4,015 MeV
Impiegando neutroni termici e quindi di minor energia rispetto a quelli dei raggi cosmici si ha invece:
- 14N + n → 15N* → 15N + γ ΔE = −10,83 MeV
| Ciclo del carbonio |
|---|
| 12C + p → 13N + γ 13N → 13C + e+ + v |
I raggi γ emessi hanno una frequenza caratteristica (intorno a ΔE/h) e, poiché la maggioranza degli esplosivi di largo impiego contiene quantità importanti di azoto (tritolo 18,5%, nitroglicerina 18,5%, ciclonite o T4 37,8%, PETN 17,7%, tetryl 24,4%), questo fatto permette di sfruttare tale reazione nei rilevatori di esplosivi negli aeroporti.
Separazione isotopica
L'arricchimento isotopico di 15N viene solitamente eseguito per scambio chimico, anche se recentemente sono stati messi a punto promettenti metodi cromatografici che sfruttano polimeri criptanti. Il sistema più efficiente e dunque più usato si basa sul seguente equilibrio bifasico:
15NO(g) + 14NOTemplate:Apici e pedici(aq) ⇄ 14NO(g) + 15NOTemplate:Apici e pedici(aq) (K = 1,055)
grazie al quale si riescono a ottenere concentrazioni di 15N superiori al 99,5%.
Altre reazioni impiegate per l'arricchimento sono:
15NH3(g) + 14NHTemplate:Apici e pedici(aq) ⇄ 14NH3(g) + 14NHTemplate:Apici e pedici(aq)
15NO(g) + 14NO2(g) ⇄ 14NO(g) + 15NO2(g)
La distillazione frazionata di NO è un altro buon metodo per l'arricchimento dell'isotopo 15N. Il prodotto finale conterrà anche una significativa concentrazione dell'isotopologo 15N18O, fonte utile del più pesante isotopo stabile dell'ossigeno.
L'acido nitrico, l'ammoniaca, i sali di ammonio, l'azoto molecolare N2, gli ossidi NO e NO2 sono disponibili in commercio con diversi gradi di arricchimento dell'isotopo 15N; da questi si possono ottenere i traccianti impiegati in numerosi ambiti di ricerca, molti dei quali sfruttano le tecniche di risonanza magnetica nucleare.
Spettroscopia di risonanza magnetica nucleare
Entrambi gli isotopi stabili dell'azoto (14N e 15N) hanno spin nucleare e possono dunque essere sfruttati nelle tecniche di spettroscopia NMR. La sensibilità con cui può essere rivelato 14N è di circa un millesimo rispetto a quella di 1H, ma superiore di circa 5 volte rispetto a quella di 13C. Per 15N è notevolmente inferiore sia a 1H che a 13C. 14N ha inoltre un momento di quadrupolo nucleare che comporta l'allargamento delle linee, un inconveniente che può indurre in taluni casi a preferire 15N nonostante la scarsa disponibililtà e minore sensibilità.
Gli studi NMR dei nuclidi di azoto hanno ormai acquisito notevole importanza e versatilità: l'impiego spazia dall'indagine strutturale a quella sui meccanismi di reazione, dal riconoscimento di nuove specie allo studio della natura dei legami di specie contenenti azoto.
Caratteristiche atomiche
È il primo elemento del gruppo 15 del sistema periodico, facente parte del blocco p.[1] Nella lingua inglese viene anche classificato come elemento pictogeno, termine poco usato nella lingua italiana. Nell'N2 i due atomi di azoto sono legati tra di loro attraverso un triplo legame.[8]
| Caratteristiche atomiche | |
|---|---|
| Configurazione elettronica fondamentale | 1s22s22p3 |
| Stati | 4S, 2D, 2P |
| Energia di 1ª ionizzazione | Template:M |
| Energia di 2ª ionizzazione | 29,6013 eV |
| Energia di 3ª ionizzazione | 47,44924 eV |
| Energia di 4ª ionizzazione | 77,4735 eV |
| Energia di 5ª ionizzazione | 97,8902 eV |
| Energia di 6ª ionizzazione | 552,0718 eV |
| Energia di 7ª ionizzazione | 667,046 eV |
| Affinità elettronica | −0,07 eV |
| Elettronegatività (Pauling) | 3,04 |
| Elettronegatività (Mulliken) | 3,08 |
| Elettronegatività (Allred-Rochow) | 3,07 |
| Polarizzabilità | - |
| Raggio atomico | Template:M |
| Raggio ionico di N3− | 1,71 Å |
| Raggio di van der Waals | 1,55 Å |
Valenza
L'azoto è uno degli atomi più importanti nella chimica organica, inorganica e biochimica grazie alla sua presenza in una varietà di stati di valenza, con diversi tipi di legami e stereochimica.[40]
L'atomo di azoto può avere 3 o 5 elettroni nel guscio di valenza[2] e il suo stato elettronico fondamentale è 4s. L'energia di 1ª ionizzazione ha un valore particolarmente elevato; contrariamente a quanto si potrebbe prevedere dall'andamento periodico, è maggiore di quello dell'ossigeno. Anche l'affinità elettronica assume un valore che devia, in questo caso in maniera molto più marcata, dalla periodicità della proprietà, presentando addirittura valore negativo. Questi andamenti si ripresentano per tutti gli elementi del gruppo, anche se in misura più sfumata man mano che aumenta il numero atomico, e possono essere giustificati, nell'ambito del modello orbitalico, considerando che gli elettroni nello stato fondamentale dell'atomo di azoto si dispongono riempiendo per metà il guscio p. Tale disposizione, con un solo elettrone per ogni orbitale p, minimizza le repulsioni interelettroniche e rende relativamente stabile l'atomo rispetto sia alla perdita che al guadagno di un elettrone.
Per quanto riguarda l'elettronegatività e il raggio atomico, i valori rispettano bene la regolarità dell'andamento periodico.
L'energia di dissociazione dell'N2 è pari 225,1 kcal/mole.[41]
Ha un tempo di vita relativamente lungo perché la ricombinazione ha ordine di reazione 3
- N(g) + N(g) + M(g) → N2(g) + M*(g)
M può essere sia l'azoto atomico N che l'azoto molecolare N2.
La costante di velocità a Template:M è Template:Val La ricombinazione deve essere necessariamente del 3º ordine per via dell'elevata esotermicità della reazione, è indispensabile che una terza specie chimica assorba l'energia sviluppata, altrimenti il sistema dissocerebbe nuovamente. Come è facile immaginare, l'azoto atomico è estremamente reattivo, per esempio, reagisce con:
- gli idrocarburi formando HCN, RCN e C2N2
- O2 formando NO e NO2
- H2 dando ammoniaca
- CO2 producendo NO e CO
È stata preparata la specie NC60 in cui l'atomo di azoto è incapsulato nel fullerene C60.
Allotropi
L'unico allotropo rilevato in natura è la molecola diatomica o biatomica N2. Di norma è chiamato semplicemente "azoto", ma le seguenti diciture sono molto più chiare: azoto molecolare, azoto biatomico o diazoto.
Dal 1890 è nota la specie chimica NTemplate:Apici e pedici, chiamato ione azoturo. Tende a formare composti esplosivi con metalli: gli azoturi di piombo, mercurio e bario, per esempio, vengono impiegati nelle capsule di detonazione.
Recentemente è stata riportata la sintesi della specie NTemplate:Apici e pedici detta pentazenio in ambiente superacido[42]. Template:Senza fonte
Metodi di preparazione
La distillazione dell'aria liquida produce azoto con una purezza superiore al 99,99%, ma piccole quantità di azoto molto puro possono essere ottenute dalla decomposizione termica dell'azoturo di sodio:[43]
In laboratorio N2 si può ottenere sottraendo O2 all'aria facendola passare attraverso fili di rame al calor rosso; si può anche, e questa è un'area di ricerca in forte crescita, separare N2 e O2 sfruttando membrane permeabili all'ossigeno biatomico ma non all'azoto biatomico. L'azoto atomico può essere prodotto da N2, a bassa pressione, con scariche elettriche.
Un altro metodo è la decomposizione termica di alcuni sali che contengono l'azoto, per esempio:
Se si vuole ottenere N2 a maggior grado di purezza, si sfrutta la decomposizione termica di un azoturo di un metallo alcalino o alcalino terroso:
Nell'industria viene ottenuto esclusivamente dalla distillazione frazionata dell'aria liquida. Di norma l'azoto molecolare N2 che ne risulta contiene impurezze in ppm, soprattutto Ar e O2, in misura più o meno significativa a seconda dei metodi impiegati e della qualità dell'impianto di produzione; le moderne colonne di frazionamento garantiscono purezze superiori al 99,9995%, dato che soddisfa la maggior parte delle necessità.
Tra i metodi di purificazione (tesi a ridurre il tenore di O2), resi oggi obsoleti dal miglioramento delle colonne di frazionamento, si annoveravano:
- la reazione con piccole quantità di idrogeno su catalizzatore di platino;
- il passaggio del gas su rame al calor rosso;
- il passaggio del gas attraverso soluzione riducente (p.e.contenente V2+ o Cr2+).
Caratteristiche fisiche e chimico-fisiche
In condizioni standard e allo stato puro, l'azoto si presenta sotto forma di gas incolore, inodore, insapore e inerte.[33][44] Più leggero dell'acqua, l'azoto molecolare galleggia.[45] Il suo coefficiente di ripartizione ottanolo-acqua è pari a 0,1,[33] mentre la solubilità in acqua si attesta pari a 1,81 x 10+4 mg/L a 21 °C.[46] L'azoto risulta inoltre: insolubile in etanolo,[47] lievemente solubile in alcol[48] e solubile in ammoniaca.[41]
Strutturali
| Caratteristiche strutturali di N2 | ||
|---|---|---|
| Gruppo puntuale | D∞h | |
| Distanza di legame (pm)
|
14N2 | 110,010 |
| 14N15N | 110,003 | |
| 15N2 | 109,998 | |
| Massa molecolare (u.a.)
|
14N2 | 28,0062 |
| 14N15N | 29,0032 | |
| 15N2 | 30,0002 | |
| Momenti d'inerzia 14N2 (g m2)
|
Ia = 0 | |
| Ib = Template:Val | ||
| Ib = Template:Val | ||
Elettroniche
| Caratteristiche elettroniche di N2 | |
|---|---|
| Configurazione elettronica | (σg1s)2(σu*1s)2(σg2s)2(σu*2s)2(πu2p)4(σg2p)2 |
| Stati | 1ΣTemplate:Apici e pedici |
| Energia di legame 14N2(kJ mol−1) | 941,7 |
| Energia di ionizzazione | Template:M |
| Momento di dipolo (Debye) | 0 |
| Polarizzabilità (10−30m³) | 1,77 |
Sia la configurazione elettronica MO che le teorie elementari della valenza sono concordi nel ritenere l'ordine di legame dell'azoto molecolare (N2) uguale a 3. Ciò è coerente con gli elevati valori dell'energia di dissociazione e della costante vibrazionale.
Spettro UPS

Il primo picco che si osserva nello spettro fotoelettronico UPS He I, quello a Template:M, porta a N2+ (2ΣTemplate:Apici e pedici) strappando un elettrone dall'orbitale σg2p. Mostra una struttura vibrazionale molto modesta, vi è solo un debole picco secondario distanziato dal primo di circa 0,267 eV, quindi la costante vibrazionale di NTemplate:Apici e pedici(2ΣTemplate:Apici e pedici) è 1906,87 N m−1. È un valore inferiore a quello di N2 ma ancora elevato, sintomo del fatto che il contributo legante dell'orbitale σg2p è scarso.
Il secondo picco, che porta a NTemplate:Apici e pedici (2Πu), presenta invece una struttura vibrazionale molto marcata. Si può notare che il picco più intenso della serie è quello del primo stato vibrazionale eccitato, il che significa che la distanza di legame in NTemplate:Apici e pedici (2Πu) è sensibilmente superiore a quella di N2 (1ΣTemplate:Apici e pedici). L'espulsione di un elettrone πu2p comporta quindi un importante indebolimento del legame, come si può anche dedurre dalla separazione dei livelli vibrazionali di NTemplate:Apici e pedici (2Πu) che è di circa 0,224 eV, con una costante vibrazionale che questa volta diminuisce decisamente (1351,46 N m−1).
L'ultimo picco che si può osservare in UPS è a 18,75 eV, porta a NTemplate:Apici e pedici (2ΣTemplate:Apici e pedici), la struttura vibrazionale è simile a quella del primo picco, questa volta la separazione dei livelli vibrazionali è 0,296 eV e quindi la costante vibrazionale uguale a Template:Tutto attaccato È un valore superiore a quello di N2 (1ΣTemplate:Apici e pedici) e infatti l'elettrone espulso proviene da un orbitale debolmente antilegante (σu*2s).
Spettroscopiche
| Caratteristiche spettroscopiche di N2 | |
| Costante rotazionale 14N2 (cm−1) | 1,9987 |
| Costante della distorsione centrifuga al 1º ordine (cm−1) | Template:Val |
| Frequenza vibrazionale fondamentale 14N2 (cm−1) | 2358,07 |
| Energia di punto zero 14N2 | Template:M |
| Costante vibrazionale 14N2 (N m−1) | 2293,8 |
| Termine spettroscopico | 4So3/2 |
Il piccolo valore della costante al 1º ordine della correzione centrifuga e l'elevata costante vibrazionale sono indici di una notevole rigidità della molecola e sono coerenti con l'elevata energia di legame e con l'ordine di legame uguale a 3.
Mentre lo spettro rotazionale Raman della molecola 14N15N, di simmetria C∞v, presenta intensità concordi con quanto ci si aspetterebbe dalla distribuzione di Boltzmann, la molecola 14N2, di simmetria D∞h, mostra le tipiche alternanze (in questo caso I = 1 quindi Jdispari: Jpari = 1: 2) dovute alla statistica nucleare che possono essere interpretate solo alla luce del principio di Pauli.
Termodinamiche

| Caratteristiche termodinamiche di N2[49] | |
| Punto di fusione (p = 1 bar) | 63,179 K |
| Entalpia di fusione (kJ/mol) | 0,719 |
| Punto di ebollizione (p = 1 bar) | 77,244 K |
| Entalpia di vaporizzazione (kJ /mol) | 5,586 |
| Entropia molare standard a 298 K (J/K*mol)[50] | 191,61 |
| Cp,m a 298 K (J/K*mol) | 29,125 |
| Cv,m a 298 K (J/K*mol) | 20,818 |
| Coefficiente di Joule-Thomson a 298 K (K atm−1) | 0,27 |
Stato gassoso
| Caratteristiche di N2 in fase gassosa | ||
| Densità (kg m−3, 1 bar, 298 K) | 1,1308 | |
| Gravità specifica[51] | 0,97 | |
| Temperatura critica | 126,3 K | |
| Pressione di vapore (Pa)[47] | -236°C | 1 (solido) |
| -232°C | 10 (solido) | |
| -226,8°C | 100 (solido) | |
| -220,2 °C | 1.000 (solido) | |
| -221,1 °C | 10.000 (solido) | |
| -159,9 °C | 100.000 (gassoso) | |
| Pressione critica (atm) | 33,54 | |
| Volume critico (cm³ mol−1) | 90,10 | |
| Collision cross section (nm2) | 0,43 | |
| Parametro a dell'eq. di van der Waals (atm L2 mol−2) | 1,408 | |
| Parametro b dell'eq. di van der Waals (10−2L mol−1) | 3,913 | |
| Parametro ε del potenziale di Lennard-Jones (K/k) | 91,85 | |
| Parametro r0 del potenziale di Lennard-Jones (pm) | 391,9 | |
| Costante della legge di Henry a 298 K (K/torr) per H2O | Template:Val | |
| Entalpia di fisisorbimento (max osservata) (kJ mol−1) | −21 | |
| Entalpia di chemisorbimento (kJ mol−1) | Ta | −589 |
| Fe | −293 | |
| Viscosità (Pa.s) | 100K | 7,0 |
| 200K | 12 | |
| 300K | 17,9 | |
| 400K | 22,2 | |
| 500K | 26,1 | |
| 600K | 29,6 | |
Stato solido
L'azoto solidifca a -209,8°C.[1]
Sono state osservate sei fasi solide dell'azoto, denominate α, β, γ, δ, ε e ζ, ma a pressioni inferiori a Template:M esistono solo le fasi alfa e beta. La temperatura di transizione tra le due fasi alla pressione di 1 bar è Template:M. La fase alfa, quella che esiste alla temperatura più bassa, ha un reticolo cubico a facce centrate Template:M), mentre la fase beta un reticolo esagonale (Template:Val e Template:Val). La fase gamma ha un reticolo tetragonale a corpo centrato. Le altre fasi sono stabili solo a pressioni superiori a Template:M.
Sopra l'elevatissima pressione di 1,5 Mbar vi è una fase semiconduttrice. Non sono ancora stati eseguiti studi strutturali accurati, ma da misure spettroscopiche si può dedurre che non siano più presenti molecole N2.
Proprietà di trasporto
| Proprietà di trasporto di N2 in fase gassosa (p = 1 bar, T = 298 K) | |
| Conducibilità termica (W m−1 s−1) | 0,025724 |
| Conducibilità elettrica | — |
| Viscosità (μP) | 178,05 |
| Velocità del suono (m s−1) | 351,98 |
| Proprietà di trasporto di N2 in fase liquida (p = 1 bar, T = 77,244 K, p.eb.) | |
| Conducibilità termica (W m−1 s−1) | 0,14605 |
| Conducibilità elettrica | — |
| Viscosità (μP) | 1613,7 |
| Velocità del suono (m s−1) | 852,53 |
Proprietà chimiche
L'N2 è la base coniugata del diazinio[8] e si comporta come accettore di legami a idrogeno.[33]
Considerazioni generali
Presenta un'eccezionale inerzia chimica, dovuta principalmente all'elevata energia di legame, alla scarsa polarizzabilità e all'assenza di momento dipolare.[52] L'azoto è un tipico non metallo ed è uno dei pochi elementi per cui la regola dell'ottetto è valida con poche eccezioni. La sua chimica è quasi esclusivamente covalente, l'anione N3− è fortemente polarizzabile e può essere individuato come tale solo nei nitruri dei metalli alcalini e alcalino terrosi. È Importante notare che mentre lo stato fondamentale N(⁴s) non reagisce con H₂, lo stato eccitato N(²D) forma NH₂.[52]
Come il carbonio, l'azoto ha quattro orbitali di valenza (uno 2s e tre 2p), quindi può partecipare al massimo a quattro legami di coppia usando orbitali ibridi sp3. Tuttavia, a differenza del carbonio, l'azoto non forma lunghe catene a causa delle interazioni repulsive tra coppie solitarie di elettroni su atomi adiacenti. Queste interazioni diventano significative alle distanze internucleari più corte incontrate con i piccoli elementi del secondo periodo dei gruppi 15, 16 e 17. I composti stabili con legami N–N sono limitati a catene di non più di tre atomi di azoto, come lo ione azide (N3−).[43]
L'azoto è l'unico pnicogeno che normalmente forma legami multipli con sé stesso e con altri elementi del secondo periodo, utilizzando la sovrapposizione π degli orbitali np adiacenti. Pertanto, il legame N≡N è più forte (DN≡N = 942 kJ/mol) rispetto ai legami N–N e N=N (DN–N = 167 kJ/mol; DN=N = 418 kJ/mol), dunque tutti i composti contenenti legami N–N e N=N sono termodinamicamente instabili rispetto alla formazione di N2. In effetti, la formazione del legame N≡N è così favorita termodinamicamente che praticamente tutti i composti contenenti legami N–N sono potenzialmente esplosivi.[43]
Stereochimica
| Numero di coordinazione | Geometria | Esempi |
| 0 | azoto atomico | |
| 1 | NO, N2, C2N2, CN−, RCN, NNO | |
| 2 | lineare | HNNN, [[Nitronio|NOTemplate:Apici e pedici]] |
| angolare | [[Nitrito|NOTemplate:Apici e pedici]], [[Ione ammiduro|NHTemplate:Apici e pedici]], ClNO, NO2 | |
| 3 | piramidale | NH3, N2H4, Ammine, NCl3 |
| planare | HNO3, FNO2 | |
| 4 | tetraedrica | [[Ammonio|NHTemplate:Apici e pedici]], NF3O, [[Ione tetrafluorammonio|NFTemplate:Apici e pedici]] |
| 5 | bipiramide trigonale | [N(AuPPh3)5]+ |
| 6 | ottaedrica | nitruri interstiziali |
| 8 | cubica | nitruri ternari |
Reazioni nell'atmosfera
Chemosfera
Nella parte alta della chemosfera, tra i 65 e i 120 km, l'attività chimica principale riguarda le reazioni delle specie atomiche, incluso l'azoto. Gli atomi coinvolti sono quelli che si producono per fotolisi dei gas atmosferici molecolari che reagiscono tra di loro e con le altre molecole presenti. Le reazioni predominanti che avvengono tra l'azoto e l'ossigeno sono:[53]
Le equazioni differenziali che descrivono i tassi di variazione della densità delle varie specie dell'azoto sono:[53]
Fulmini
I fulmini facilitano la reazione tra l'azoto e l'ossigeno molecolare con formazione di monossido d'azoto secondo la reazione:[54]
Reazioni a temperatura ambiente
Le uniche reazioni note dell'N2 a temperatura ambiente sono:
- l'ossidazione del litio metallico, una reazione molto lenta[55]
- la formazione di complessi con alcuni metalli di transizione[56]
- [Ru(NH3)5(H2O)]2+(aq) + N2(g) → [Ru(NH3)5(N2)]2+(aq) + H2O
- WCl4(PMe2Ph)2 + 2 N2(g) + 2 PMe2Ph + 4 Na(Hg) → W(PMe2Ph)4(N2)2 + 4 NaCl
- MoCl5 + 4 PR3 + 2 N2(g) + 5 Na(Hg) → trans-Mo(N2)2(PR3)4 + 5 NaCl
Reazioni a temperature elevate
A temperature più elevate l'N2 reagisce con elementi più elettropositivi, come quelli del gruppo 13, per dare nitruri binari, che vanno da covalenti a ionici. Come i corrispondenti composti del carbonio, i composti binari dell'azoto con ossigeno, idrogeno o altri non metalli sono solitamente sostanze molecolari covalenti.[43]
Pochi composti molecolari binari dell'azoto si formano per reazione diretta degli elementi. Ad alte temperature, N2 reagisce con:[43]
- H2 per formare ammoniaca,
- O2 per formare una miscela di NO e NO2,
- il carbonio per formare cianogeno (N≡C–C≡N)
L'azoto elementare non reagisce con gli alogeni o altri calcogeni. Tuttavia, tutti gli alogenuri di azoto binari (NX3) sono conosciuti. Ad eccezione di NF3, tutti sono tossici, termodinamicamente instabili e potenzialmente esplosivi, e tutti vengono preparati reagendo l'alogeno con NH3 piuttosto che con N2.[43]
Sia il monossido di azoto (NO) che il biossido di azoto (NO2) sono termodinamicamente instabili, con energie libere di formazione positive. A differenza di NO, NO2 reagisce prontamente con acqua in eccesso, formando una miscela 1:1 di acido nitroso (HNO2) e acido nitrico (HNO3). L'azoto forma anche N₂O (monossido di diazoto, o ossido nitroso), una molecola lineare isoelettronica con il CO₂ e può essere rappresentata come −N=N+=O. Come gli altri due ossidi di azoto, l'ossido nitroso è termodinamicamente instabile.[43]
Ad alte temperature, l'azoto reagisce con i metalli altamente elettropositivi per formare nitruri ionici, come Li₃N e Ca₃N₂. Questi composti sono costituiti da reticoli ionici formati da ioni Mn⁺ e N³⁻. Proprio come il boro forma boruri interstiziali e il carbonio forma carburi interstiziali, con i metalli meno elettropositivi l'azoto forma una gamma di nitruri interstiziali, nei quali l'azoto occupa i "vuoti" di una struttura metallica compatta. Come i carburi e i boruri interstiziali, queste sostanze sono tipicamente materiali molto duri, con elevati punti di fusione, una lucentezza metallica e conduttività.[43]
L'azoto reagisce anche con i metalloidi a temperature molto elevate per produrre nitruri covalenti, come Si₃N₄ e BN, che sono solidi con strutture reticolari covalenti estese simili a quelle della grafite o del diamante. Di conseguenza, sono materiali solitamente ad alto punto di fusione e chimicamente inerti.[43]
Processo di Haber-Bosch
La reazione che più è stata studiata per via dell'enorme interesse pratico è la sintesi dell'ammoniaca secondo il processo Haber-Bosch:
- N2(g) + 3 H2(g) ⇄ 2 NH3(g)
Si esegue a temperature comprese tra 450 e Template:M, a pressioni comprese tra 200 e 1000 atm, in presenza di un catalizzatore, l'ossido ferroso-ferrico (Fe3O4), e tracce di Al2O3.[54] Prima della messa a punto del processo Haber uno dei metodi utilizzati per la fissazione dell'azoto era la reazione di azoto con carburo di calcio per dare calcio cianammide:
- N2(g) + CaC2(s) → CaNCN(s)
La reazione avviene intorno ai 1000 °C.
Ma il primo metodo industriale per la fissazione dell'azoto, proposto dall'inglese William Crookes e poi migliorato dai norvegesi Birkeland ed Eyde, era basato sull'ossidazione da parte di O2:
- N2(g) + O2(g) → 2 NO(g) ΔrHº(298 K) = 90,29 kJ mol−1
Data l'elevata endotermicità della reazione, nel processo Birkeland-Eyde si operava ad elevata temperatura insufflando aria su un arco elettrico di forma circolare.
Legami a idrogeno
L'azoto è tra gli atomi più elettronegativi e quindi, così come l'ossigeno e il fluoro, è in grado di partecipare alla formazione di legami a idrogeno agendo sia da donatore di protoni che come accettore.
La lunghezza tipica dei legami a idrogeno N-H··N si aggira intorno ai Template:M. Legami di questo tipo sono responsabili dell'elevato punto di ebollizione dell'ammoniaca se paragonato a quello degli altri idruri degli elementi del 15º gruppo della tavola periodica. Questo costituisce un esempio classico degli effetti del legame a idrogeno.
Legami a idrogeno in cui sono coinvolti atomi di azoto giocano un ruolo fondamentale nell'accoppiamento dei nucleotidi nella struttura del DNA, tenendo "incollati" i due filamenti che formano la doppia elica. Anche la struttura delle proteine è fortemente influenzata da legami a idrogeno che coinvolgono atomi di azoto.
Chimica redox in soluzione acquosa
Nonostante non abbiano significato fisico, i numeri di ossidazione sono spesso impiegati, soprattutto in ambito didattico, per razionalizzare la chimica degli elementi e per bilanciare le reazioni di ossidoriduzione. L'azoto in questo senso è uno degli elementi che presenta la maggior varietà, adottando tutti i valori da −3 a +5. Uno strumento efficace per visualizzare le stabilità termodinamiche relative dei diversi stati di ossidazione in soluzione acquosa può essere fornita da un diagramma di Frost:
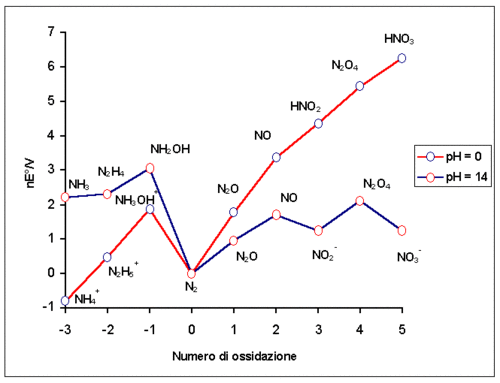
Specie chimiche che hanno elevata stabilità termodinamica rispetto a numerose reazioni (che dunque spesso possono favorire le reazioni che le vedono come prodotti) vengono talvolta chiamate pozzi termodinamici. Fra queste si possono annoverare CO2, H2O, NaCl e appunto N2. Questa caratteristica dell'azoto è l'aspetto più evidente del diagramma.
È però necessario osservare che la formazione di N2 è cineticamente sfavorita, e quasi sempre la riduzione di nitrati e nitriti si ferma a NO2 o NO, talvolta anche procedere fino a NHTemplate:Apici e pedici.
Si può notare che la chimica redox dei composti dell'azoto è significativamente influenzata dal pH, in particolare nitrati e nitriti, che a pH bassi sono forti ossidanti, perdono quasi totalmente il loro potere ossidante in ambiente alcalino.
Viene di seguito riportata una tabella che raccoglie i potenziali standard per alcune semireazioni in cui compaiono specie chimiche contenenti azoto.
| Semireazione di riduzione | Eº (V) |
| H2N2O2 + 2 H+ + 2 e− → N2 + 2 H2O | +2,65 |
| HN3 + 3 H+ + 2 e− → NHTemplate:Apici e pedici + N2 | +1,96 |
| N2O + 2 H+ + 2 e− → N2 + H2O | +1,77 |
| NO+ + e− → NO | +1,46 |
| 2 NH3OH+ + H+ + 2 e− → 2 N2HTemplate:Apici e pedici + 2 H2O | +1,42 |
| NH3OH+ + 2 H+ + 2 e− → NHTemplate:Apici e pedici + H2O | +1,35 |
| HNO2 + 4 H+ + 4 e− → N2O + 3 H2O | +1,29 |
| N2HTemplate:Apici e pedici + 3 H+ + 2 e− → 2 NHTemplate:Apici e pedici | +1,275 |
| N2O4 + 2 H+ + 2 e− → 2 HNO2 | +1,065 |
| N2O4 + 4 H+ + 2 e− → 2 NO + 2 H2O | +1,035 |
| HNO2 + H+ + e− → NO + H2O | +0,983 |
| NOTemplate:Apici e pedici + 4 H+ + 3 e− → NO + 2 H2O | +0,957 |
| NOTemplate:Apici e pedici + 3 H+ + 2 e− → HNO2 + H2O | +0,94 |
| 2 HNO2 + 4 H+ + 4 e− → H2N2O2 + 2 H2O | +0,86 |
| 2 NOTemplate:Apici e pedici + 4 H+ + 2 e− → N2O4 + 2 H2O | +0,803 |
| 2 NO + 2 H+ + 2 e− → H2N2O2 | +0,712 |
| HN3 + 11 H+ + 8 e− → 3 NHTemplate:Apici e pedici | +0,695 |
| H2N2O2 + 6 H+ + 4 e− → 2 NH3OH+ | +0,387 |
| N2 + 5 H+ + 4 e− → N2HTemplate:Apici e pedici | -0,23 |
| 3/2 N2 + H+ + e− → HN3 | -3,09 |
Azotofissazione
Template:Vedi anche Nel suolo esistono microrganismi che possiedono enzimi in grado di catalizzare il fissaggio dell'azoto, ovvero la conversione dell'azoto molecolare dell'aria in ammoniaca, che a sua volta viene usata dalle piante nella sintesi proteica.[1]
Composti dell'azoto
Applicazioni
Circa il 90% dell'azoto prodotto oggi viene utilizzato per fornire un'atmosfera inerte per processi o reazioni sensibili all'ossigeno, come la produzione dell'acciaio, la raffinazione del petrolio e il confezionamento di alimenti e prodotti farmaceutici.[43]
Fertilizzanti

Applicazioni criogeniche dell'azoto liquido
Template:Vedi anche L'azoto liquido, o meglio N2 liquido, avendo il punto di ebollizione a −195,82 °C e un costo di produzione ragionevole, è molto utilizzato per il raffreddamento di apparecchiature scientifiche, la crioconservazione di campioni biologici e vari altri processi nei quali è necessario ottenere o conservare temperature estremamente basse.
Applicazioni per atmosfere inerti
L'azoto molecolare N2 è particolarmente indicato per la creazione di atmosfere inerti in diversi ambiti industriali e tecnologici in virtù della sua scarsa reattività, dell'abbondanza e del basso costo. Viene dunque preferito all'argon Ar, gas che offre in assoluto le prestazioni migliori, in quasi tutte le applicazioni a temperatura ambiente, talvolta anche alle alte temperature.
Industria chimica e petrolchimica
In diverse reazioni chimiche, condotte sia nell'industria sia nei laboratori, è richiesta un'atmosfera priva di O2 affinché si giunga ai prodotti desiderati. Grandi quantità di azoto sotto forma di azoto molecolare (N2) vengono riservate per questo scopo.
N2 viene anche impiegato per le bonifiche e le polmonazioni di reattori e serbatoi, sempre per evitare che i composti contenuti possano reagire, anche in maniera esplosiva, con O2 contenuto dell'aria.
Nella lavorazione delle materie plastiche si usa l'azoto per la produzione di polimeri espansi e nello stampaggio ad iniezione assistito da gas.
Metallurgia
In numerosi processi metallurgici è indispensabile un'atmosfera priva di ossigeno per evitare la formazione di ossidi, l'azoto non è indicato come materiale inerte per tutti i trattamenti, poiché ad alta temperatura reagisce con alcuni metalli, in alcuni trattamenti termico-metallurgici l'interazione è voluta:
- Nella ricottura (annealing, in inglese) di acciai, rame, alluminio e altri metalli e leghe; in alcuni processi è necessaria una diluizione con argon (decisamente migliore) per mantenere l'inerzia dell'azoto.
- Nella sinterizzazione di acciaio e alluminio.
- Come costituente delle miscele nella carbocementazione in fase gassosa degli acciai.
- Nella protezione durante la brasatura, il taglio e la saldatura; i metalli più reattivi nei confronti dell'azoto, per esempio titanio e zirconio, necessitano dell'argon come gas protettivo.
- Nella tempra di acciai in forni sottovuoto.
- Come elemento di apporto nella nitrurazione ad alta temperatura degli acciai, dove la formazione di nitruri conferisce durezza e resistenza alla usura al metallo negli strati superficiali, conservando per contro resilienza agli strati profondi.
Industria alimentare
L'azoto è largamente impiegato, puro o in miscela, nella conservazione in atmosfera protettiva di prodotti alimentari industriali.[45] Miscele particolarmente ricche di azoto sono usate nella protezione di alimenti che contengono quantità significative di grassi insaturi: in questi casi l'O2 viene eliminato per evitare l'irrancidimento. Viene inoltre utilizzato come propellente nelle bombolette spray alimentari.[8]
L'azoto molecolare N2 viene di norma impiegato nell'imbottigliamento dei vini, per evitare che il vino venga a contatto con ossigeno molecolare O2.
Industria elettronica
Nella produzione di componenti elettronici come transistor, diodi e circuiti integrati si usa l'azoto sia come gas vettore dei gas di processo, sia per la creazione di atmosfere inerti durante i trattamenti termici.
Condizionamento
L'azoto viene utilizzato negli impianti frigoriferi e condizionatori per la prova di tenuta di tubazioni e saldature sotto pressione, prima di effettuare la carica di gas refrigerante con il quale funzioneranno gli impianti. Durante le operazioni di riparazione viene inoltre utilizzato per pulire la parte interna dei tubi dalle impurità e i residui che si vengono a creare durante le saldature sul rame.[57]
Reattori nucleari
Il radioisotopo 16N è il radionuclide dominante nel refrigerante dei reattori ad acqua pressurizzata o dei reattori ad acqua bollente durante il normale funzionamento. È prodotto dall'16O (in acqua) attraverso la reazione (n, p). Ha una breve emivita di circa Template:M, ma durante il suo decadimento di ritorno all'16O produce radiazioni gamma ad alta energia (da 5 a Template:M), per cui l'accesso alla conduttura primaria del refrigerante in un reattore ad acqua pressurizzata deve essere segregato durante il funzionamento del reattore della centrale.[58] Il 16N è uno dei principali mezzi usati per rilevare immediatamente anche le più piccole perdite dal ciclo primario del refrigerante e quello secondario del vapore.[58]
Altre applicazioni dell'azoto molecolare
Viene anche usato per:
- gonfiare gli pneumatici delle automobili e degli aerei,[45]
- spurgare l'interno di binocoli, impianti di raffreddamento e condizionamento[45]
- flussaggio dei serbatoi
- nell'estrazione di petrolio e gas naturale
- nel laser ad azoto[59]
- il flussaggio di serbatoi e tubazioni industriali (il flusso di N2 rimuove l'ossigeno con gli eventuali gas o fluidi combustibili o reattivi contenuti)
- causare ipossia nei condannati a morte in Alabama costretti a respirarlo attraverso una apposita maschera. La prima esecuzione con l'azoto avvenne il 22 gennaio 2024 nel carcere di Atmore nei confronti di Kenneth Eugene Smith, morto tra gli spasmi dopo 22 minuti di inalazione forzata del gas inerte.[60]
Applicazioni degli isotopi dell'azoto
Gli isotopi dell'azoto vengono principalmente utilizzati nei campi degli studi ambientali e paleoambientali, della diagenesi dei sedimenti, della formazione ed evoluzione del suolo, negli studi archeologici e sulla dieta paleolitica.[61]
Il rapporto isotopico δ15N dei sali di ammonio atmosferici può essere misurato per rintracciarne l'origine rappresentando un valido elemento per il tracciamento delle fonti inquinanti, poiché i valori di δ15N dell'NH3 emesso da fonti diverse sono differenti.[39]
Composti arricchiti artificialmente con 15N sono comunemente usati negli studi di fisiologia vegetale e agricoltura per stabilire meccanismi biochimici dettagliati (es. identificare e quantificare i percorsi biologici e chimici tra questi pool di azoto).[62]
Il 13N viene utilizzato negli studi medici per la tomografia a emissione di positroni (PET). È necessario che il 13N venga prodotto in loco in un ciclotrone, con la sintesi di 13NH3, che viene poi iniettato nel paziente per l'imaging PET. Questo consente di dedurre un gran numero di parametri cardiaci (flusso sanguigno, volume dei ventricoli) e, se presenti, eventuali anomalie cardiache.[39]
Precauzioni
L'azoto molecolare è un composto atossico e non combustibile che da solo non è in grado di supportare la vita. Se i contenitori contenenti azoto sono sottoposti a calore prolungato possono esplodere violentemente a causa dell'aumento di pressione all'interno degli stessi.[45]
Viene assorbito dall'organismo attraverso la respirazione. In caso di perdita del contenitore, questa sostanza può causare asfissia per diminuzione del contenuto di ossigeno atmosferico in ambienti confinati, elevate concentrazioni di azoto possono infatti portare alla perdita di conoscenza e anche alla morte[51]
Ad alte pressioni parziali, raggiungibili con camere iperbariche o durante le immersioni subacquee, l'azoto si comporta come gas narcotico ed è la causa principale della malattia da decompressione. Particolare attenzione va posta nell'utilizzo di tale gas nella forma liquida. Le ustioni dovute al freddo non sono immediatamente avvertibili. I recipienti contenenti azoto liquido a contatto con l'aria tendono a rilasciare il liquido e contemporaneamente a condensare umidità, O2 e acetilene al loro interno, formando in tal modo atmosfere ipossiche (con scarsità di O2) che in ambiente poco ventilato possono risultare fatali.
Normativa
Note
- ↑ 1,0 1,1 1,2 1,3 1,4 Template:Cita libro
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Template:Cita web
- ↑ Template:Cita pubblicazione
- ↑ Template:Cita web
- ↑ Template:Cita libro
- ↑ Template:Cita libro
- ↑ 7,0 7,1 7,2 Template:Cita pubblicazione
- ↑ 8,0 8,1 8,2 8,3 Template:Cita web
- ↑ 9,0 9,1 Template:Cita pubblicazione
- ↑ Template:Cita pubblicazione
- ↑ 11,0 11,1 Template:Cita pubblicazione
- ↑ Template:Cita pubblicazione
- ↑ Template:Cita pubblicazione
- ↑ 14,0 14,1 14,2 Template:Cita pubblicazione
- ↑ Template:Cita pubblicazione
- ↑ Template:Cita pubblicazione
- ↑ Template:Cita libro
- ↑ Template:Cita pubblicazione
- ↑ Template:Cita pubblicazione
- ↑ 20,0 20,1 Template:Cita pubblicazione
- ↑ Template:Cita pubblicazione
- ↑ 22,0 22,1 Template:Cita libro
- ↑ 23,0 23,1 Template:Cita pubblicazione
- ↑ Template:Cita pubblicazione
- ↑ Template:Cita web
- ↑ Template:Cita web
- ↑ Template:Cita libro
- ↑ 28,0 28,1 Template:Cita pubblicazione
- ↑ 29,0 29,1 29,2 Template:Cita pubblicazione
- ↑ Template:Cita pubblicazione
- ↑ Template:Cita pubblicazione
- ↑ 32,0 32,1 Template:Cita pubblicazione
- ↑ 33,0 33,1 33,2 33,3 Template:Cita web
- ↑ 34,0 34,1 34,2 Template:Cita libro
- ↑ Template:Cita web
- ↑ Template:Cita web
- ↑ Template:Cita pubblicazione
- ↑ Template:Cita libro
- ↑ 39,0 39,1 39,2 Template:Cita pubblicazione
- ↑ Template:Cita libro
- ↑ 41,0 41,1 Template:Cita pubblicazione
- ↑ Template:Cita web
- ↑ 43,00 43,01 43,02 43,03 43,04 43,05 43,06 43,07 43,08 43,09 Template:Cita web
- ↑ Template:Cita web
- ↑ 45,0 45,1 45,2 45,3 45,4 Template:Cita web
- ↑ Template:Cita pubblicazione
- ↑ 47,0 47,1 Template:Cita pubblicazione
- ↑ Template:Cita pubblicazione
- ↑ Template:Cita web
- ↑ Template:Cita pubblicazione
- ↑ 51,0 51,1 Template:Cita web
- ↑ 52,0 52,1 Template:Cita pubblicazione
- ↑ 53,0 53,1 Template:Cita pubblicazione
- ↑ 54,0 54,1 Template:Cita web
- ↑ Template:Cita pubblicazione
- ↑ Template:Cita libro
- ↑ Template:Cita web
- ↑ 58,0 58,1 Template:Cita libro
- ↑ Template:Cita web
- ↑ Template:Cita web
- ↑ Template:Cita libro
- ↑ Template:Cita libro
Bibliografia
- Template:Cita libro
- Template:Cita libro
- F. A. Cotton G. Wilkinson, Chimica Inorganica, Casa Editrice Ambrosiana, 3ª Edizione, 1984
- N. N. Greenwood A. Earnshaw, Chemistry of the Elements, Butterworth Heinemann, 2ª Edizione, 1997
- D. F. Shriver P. W. Atkins, Inorganic Chemistry, Oxford University Press, 3ª Edizione, 1999
- L. Malatesta, Compendio di Chimica Inorganica, Casa Editrice Ambrosiana, 4ª Edizione, 1999
- L. Berti M. Calatozzolo R. di Bartolo, L'industria dell'azoto, Casa Editrice G.D'Anna, 1994
- A. J. Ihde, The Development of Modern Chemistry, Dover Publications, 2ª Edizione, 1984
- C. E. Wayne R. P. Wayne, Photochemistry, Oxford Chemistry Primers, 1999
- P. W. Atkins, Physical Chemistry, Oxford University Press, 6ª Edizione, 1998
Voci correlate
- Azotemia
- Azoto liquido
- Azoto ureico
- Bilancio dell'azoto
- Ciclo dell'azoto
- Ciclo del carbonio-azoto
- Economia ad azoto liquido
- Narcosi da azoto
- Pioggia acida
- Buco dell'ozono
Altri progetti
Collegamenti esterni
Template:Elementi chimici Template:Controllo di autorità Template:Portale