Acido coniugato
Template:NN Secondo la teoria acido-base di Brønsted-Lowry, un acido coniugato è la parte acida di una coppia di specie chimiche che si formano in conseguenza della ionizzazione di un acido () in seguito alla perdita di un idrogenione (). La parte basica che si forma in seguito al trasferimento () è chiamata base coniugata[1].
In soluzioni acquose, supponendo che sia un acido generico e la sua base coniugata, la reazione chimica di equilibrio che avviene è della forma:
- Acido + Base Base coniugata + Acido coniugato


Johannes Nicolaus Brønsted e Thomas Martin Lowry introdussero la teoria di Brønsted-Lowry, che proponeva che qualsiasi composto che può trasferire un protone a qualsiasi altro composto è un acido, e il composto che accetta il protone è una base. Un protone è una particella nucleare con un'unità di carica elettrica positiva; è rappresentato dal simbolo perché costituisce il nucleo di un atomo di idrogeno[2], cioè un idrone.
Un catione può essere un acido coniugato e un anione può essere una base coniugata, a seconda di quale sostanza è coinvolta e quale teoria acido-base viene considerata. L'anione più semplice che può essere una base coniugata è l'elettrone solvatato il cui acido coniugato è l'idrogeno atomico.
Reazioni acido-base
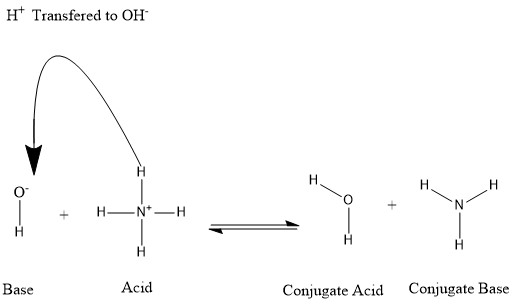
In una reazione acido-base, un acido più una base reagiscono per formare una base coniugata più un acido coniugato; i coniugati si formano quando un acido perde un protone idrogeno o una base acquista un protone idrogeno. Un esempio può essere la seguente figura:
Si dice che la molecola d'acqua () è l'acido coniugato dello ione idrossido, dopo che quest'ultimo ha ricevuto il protone idrogeno donato dall'ammonio. D'altra parte, l'ammoniaca () è la base coniugata per l'ammonio acido dopo che l'ammonio ha donato uno ione idrogeno verso la produzione della molecola d'acqua. Ci si può anche riferire a come base coniugata di , poiché la molecola d'acqua dona un protone verso la produzione di nella reazione inversa, che è il processo predominante in natura a causa della forza della base sullo ione idrossido. Sulla base di queste informazioni, è chiaro che i termini "acido", "base", "acido coniugato" e "base coniugata" non sono fissati per una determinata specie chimica, ma sono intercambiabili a seconda della reazione in atto.
Forza dei coniugati
La forza di un acido coniugato è direttamente proporzionale alla sua costante di dissociazione. Se un acido coniugato è forte, la sua dissociazione avrà una costante di equilibrio più alta e i prodotti della reazione saranno favoriti. La forza di una base coniugata può essere vista come la tendenza della specie ad "attirare" i protoni di idrogeno verso di sé. Se una base coniugata è classificata come forte, "si aggrapperà" al protone idrogeno quando è in soluzione, e il suo acido non si dissocerà.
Se una specie è classificata come un acido forte, la sua base coniugata sarà debole[3]. Un esempio di questo caso sarebbe la dissociazione dell'acido cloridrico () in acqua. Poiché l'acido cloridrico è un acido forte (si dissocia in larga misura), la sua base coniugata () sarà una base coniugata debole. Pertanto, in questo sistema, la maggior parte dei protoni sarà sotto forma di ione idronio , invece di attaccarsi a un e la base coniugata sarà più debole di una molecola d'acqua.
D'altra parte, se una specie è classificata come un acido debole, la sua base coniugata non sarà necessariamente una base forte. Per esempio l'acetato, la base coniugata dell'acido acetico, ha una costante di dissociazione della base , che lo rende una base debole. Affinché una specie abbia una base coniugata forte deve essere un acido molto debole, come ad esempio l'acqua.
Identificazione delle coppie coniugate acido-base
Per identificare l'acido coniugato, si cerca la coppia di composti correlati. La reazione acido-base può essere vista in un senso prima e dopo. Il prima è il lato reagente dell'equazione, il dopo è il lato prodotto dell'equazione. L'acido coniugato nel lato successivo di un'equazione guadagna uno ione idrogeno, quindi nel lato anteriore dell'equazione il composto che ha uno ione idrogeno in meno dell'acido coniugato è la base. La base coniugata nel lato successivo dell'equazione ha perso uno ione idrogeno, quindi nel lato anteriore dell'equazione, il composto che ha uno ione idrogeno in più della base coniugata è l'acido.
Si consideri la seguente reazione acido-base:
L'acido nitrico () è un acido perché dona un protone alla molecola d'acqua e la sua base coniugata è il nitrato (). La molecola d'acqua funge da base perché riceve il catione idrogeno (protone) e il suo acido coniugato è lo ione idronio ().
| Equazione | Acido | Base | Base coniugata | Acido coniugato |
|---|---|---|---|---|
| acido cloroso | (acqua) | clorito | (idronio) | |
| ipoclorito | idrossido | acido ipocloroso | ||
| acido cloridrico | diidrogenofosfato | cloruro | acido fosforico |
Applicazioni
Un uso di acidi e basi coniugati risiede nei sistemi tampone, che includono una soluzione tampone. In un tampone, un acido debole e la sua base coniugata (sotto forma di sale), o una base debole e il suo acido coniugato, vengono utilizzati per limitare la variazione del pH durante un processo di titolazione. I tamponi hanno applicazioni chimiche sia organiche che non organiche. Ad esempio, oltre ai tamponi utilizzati nei processi di laboratorio, il sangue umano funge da tampone per mantenere costante il pH. Il tampone più importante nel nostro flusso sanguigno è il tampone acido carbonico-bicarbonato, che impedisce drastici cambiamenti di pH quando l'anidride carbonica viene introdotta. Questo funziona come:
- .
Inoltre, ecco una tabella di soluzioni tampone comuni:
Agente tampone pKa Range utile di pH Acido citrico 3.13, 4.76, 6.40 2.1 - 7.4 Acido acetico 4.8 3.8 - 5.8 Diidrogenofosfato di potassio 7.2 6.2 - 8.2 CHES 9.3 8.3–10.3 Borati 9.24 8.25 - 10.25
Una seconda applicazione comune con un composto organico sarebbe la produzione di un tampone con acido acetico. Se l'acido acetico, un acido debole con la formula , è stato trasformato in una soluzione tampone, dovrebbe essere combinato con la sua base coniugata sotto forma di sale. La miscela risultante è chiamata tampone acetato, costituita da e . L'acido acetico, insieme a molti altri acidi deboli, serve come componente utile dei tamponi in diverse impostazioni di laboratorio, ciascuno utilizzabile all'interno del proprio intervallo di pH.
La soluzione di lattato di Ringer è un esempio in cui la base coniugata di un acido organico, l'acido lattico () è combinato con cationi di sodio, calcio e potassio e anioni cloruro in acqua distillata[4] che insieme formano un fluido che è isotonico rispetto al sangue umano e viene utilizzato per la rianimazione di liquidi dopo la perdita di sangue dovuta a traumi, interventi chirurgici o ferite da ustioni[5].
Tavola degli acidi e loro basi coniugate
Di seguito sono tabulati diversi esempi di acidi e loro basi coniugate; si noti come differiscono di un solo protone (ione H+). La forza acida diminuisce e la forza della base coniugata aumenta con lo scorrere dell'elenco:
| Acido | Base coniugata |
|---|---|
| H2F+ Ione fluoronio | HF Acido fluoridrico |
| HCl Acido cloridrico | Cl− Ione cloruro |
| H2SO4 Acido solforico | HSOTemplate:Su Ione solfato di idrogeno |
| HNO3 Acido nitrico | NOTemplate:Su Ione nitrato |
| H3O+ Ione idronio | H2O Acqua |
| HSOTemplate:Su Ione solfato di idrogeno | SOTemplate:Su Ione solfato |
| H3PO4 Acido fosforico | H2POTemplate:Su Ione fosfato di diidrogeno |
| CH3COOH Acido acetico | CH3COO− Ione acetato |
| HF Acido fluoridrico | F− Ione fluoruro |
| H2CO3 Acido carbonico | HCOTemplate:Su Ione idrogenocarbonato |
| H2S Acido solfidrico | HS− Ione solfuro di idrogeno |
| H2POTemplate:Su Ione fosfato di diidrogeno | HPOTemplate:Su Ione idrogenofosfato |
| NHTemplate:Su Ione ammonio | NH3 Ammoniaca |
| H2O acqua (pH=7) | OH− Ione idrossido |
| HCOTemplate:Su Ione idrogenocarbonato (bicarbonato) | COTemplate:Su Ioni carbonati |
Tavola delle basi e dei loro acidi coniugati
Al contrario, ecco una tabella delle basi e dei loro acidi coniugati. Allo stesso modo, la forza della base diminuisce e la forza dell'acido coniugato aumenta lungo l'elenco:
| Base | Acido coniugato |
|---|---|
| Template:Chem Etilammina | Template:Chem Ethylammonium ion |
| Template:Chem Metilammina | Template:Chem Ione metilammonio alogenuro |
| Template:Chem Ammoniaca | Template:Chem Ione ammonio |
| Template:Chem Piridina | Template:Chem Piridinio |
| Template:Chem Anilina | Template:Chem Ione fenilammonio |
| Template:Chem Ione benzoato | Template:Chem Acido benzoico |
| Template:Chem Ione Fluoruro | Template:Chem Idrogeno fluoruro |
| POTemplate:Su Ione Fosfato | HPOTemplate:Su Ione idrogenofosfato |
| OH− Ione idrossido | H2O Acqua |
| Template:Chem Idrogenocarbonato | Template:Chem Acido carbonico |
| Template:Chem Ione carbonato | Template:Chem Idrogenocarbonato |
| Template:Chem Ione bromo | Template:Chem Bromuro di idrogeno |
| Template:Chem Ione idrogenofosfato | Template:Chem |
| Template:Chem Ione cloro | Template:Chem Acido cloridrico |
| Template:Chem Acqua | Template:Chem Ione idronio |